rangersen
Member
Hallo,
ich habe einmal eine Frage zu dem Rechner "Nährstofflösung herstellen". Folgendes habe ich eingegeben
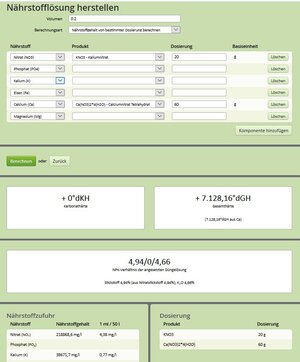
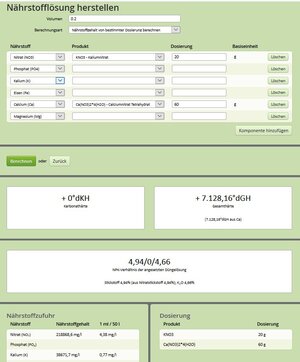
Bei diesem Bespiel hätte ich 20 gr KNO3 und 60 gr Ca(NO3)2*4(H2O) in 200ml aufgelöst. Wenn ich von dieser Lösung 1ml in 50 Liter geben, so erhöht sich z.B. der NO3-Gehalt um 4,38 mg/l. Ich hoffe ich habe hierbei aus den bereits gelesenen Foreneinträgen keinen Gedankenfehler.
Was ich allerdings nicht verstehe. Ich würde bei der Düngerherstellung in Summe 80 Gramm in 200ml Wasser geben und diese Menge löst sich in dieser Wassermenge doch niemals auf. Wie kann ich noch eine Prüfung bzgl. Löslichkeit machen.
Vorab schon vielen Dank
Wolfgang
ich habe einmal eine Frage zu dem Rechner "Nährstofflösung herstellen". Folgendes habe ich eingegeben
Bei diesem Bespiel hätte ich 20 gr KNO3 und 60 gr Ca(NO3)2*4(H2O) in 200ml aufgelöst. Wenn ich von dieser Lösung 1ml in 50 Liter geben, so erhöht sich z.B. der NO3-Gehalt um 4,38 mg/l. Ich hoffe ich habe hierbei aus den bereits gelesenen Foreneinträgen keinen Gedankenfehler.
Was ich allerdings nicht verstehe. Ich würde bei der Düngerherstellung in Summe 80 Gramm in 200ml Wasser geben und diese Menge löst sich in dieser Wassermenge doch niemals auf. Wie kann ich noch eine Prüfung bzgl. Löslichkeit machen.
Vorab schon vielen Dank
Wolfgang