Wuestenrose
Well-Known Member
Hallo,
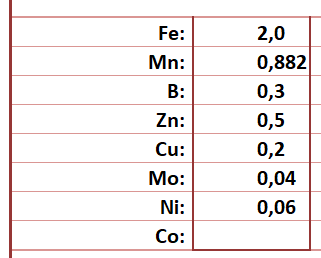
die Tage bin ich über ein interessantes Paper gestolpert, nämlich dem hier: Synthetic iron chelates as substrates of root ferric chelate reductase in green stressed cucumber plants. Darin geht's um die Reaktion von Eisen-chlorotischen Gurken auf verschiedene Eisenchelate, genauer, um die Aktivität der Eisen(III)chelatreduktase an den Wurzeln und um die Eisenkonzentration im Xylem-Saft. Gurken als Strategie-I-Pflanzen bedienen sich des Eisenchelatreduktase-Tricks zur Eisenaufnahme. Sie scheiden das Enzym an den Wurzeln aus, das vom drei- zum zweiwertigen reduzierte Eisen fällt wie von Zauberhand aus dem Komplex, weil die meisten Komplexe mit Eisen(III) viel stabiler sind als mit Eisen(II), und nehmen es auf. Innerhalb der Pflanze wird es allerdings wieder oxidiert und als Eisen(III) weitertransportiert.
An den Gurken hat man Fe(III)-EDTA und Fe(III)-EDDHA getestet. Mit dem Fe(III)-EDTA war zwar die Aktivität der Eisenchelatreduktase an den Wurzeln höher, allerdings die Eisenkonzentration im Xylemsaft geringer als beim Fe(III)-EDDHA. Warum? Fe(III)-EDTA ist weniger stabil als Fe(III)-EDDHA und kann daher von der Reduktase leichter zerlegt werden, allerdings zeigt EDTA auch noch eine gewisse Stabilität mit Fe(II). Das Eisen bleibt daher mit EDTA chelatiert und die Pflanze schaut mit'm Ofenrohr ins Gebirg… Fe(III)-EDDHA ist zwar stabiler und kann daher von der Reduktase nicht so leicht angegriffen werden, aber es zeigt keine Affinität zum Fe(II). Das kann dann die Pflanze gemütlich wegnuckeln.
Zudem: Der Fe(III)-EDTA-Komplex ist nur bis etwa pH 6,3 stabil. Mit zunehmendem pH-Wert steigt die Konzentration der Hydroxidionen (OH⁻) im Wasser. Exponentiell, wir erinnern uns, pro ganzer pH-Stufe um den Faktor 10. Diese Hydroxidionen konkurrieren mit dem EDTA ums Eisen(III) und mit zunehmendem pH-Wert verliert das EDTA das Match. Es bildet sich zunehmend unlösliches Eisen(III)-hydroxid (Fe(OH)₃), das ausfällt. Dieser Prozess beginnt bereits ab pH 6,0. Und dann wundert man sich, warum soviel Eisen im Filterschlamm landet. Ganz einfach, weil EDTA ein untauglicher Chelator ist. Zudem durchläuft es Kläranlagen fast unbeschadet, EDTA findet sich inzwischen in so gut wie allen Oberflächengewässern Deutschlands.
Trotzdem ist das Paper kaum auf Aquarien anzuwenden, weil Fe(III)-EDDHA extrem färbt, selbst noch bei aquarienüblichen 0,1 mg Eisen pro Liter. Was bieten sich dem Aquarien für Alternativen? Fe-DTPA. Besser als EDTA. Fe-IDHA. Gut, aber IDHA wird schnell organisch abgebaut, daher eher als Tagesdünger geeignet. Genauso wie organische Eisenverbindungen wie Eisengluconat und und Eisencitrat. Fe-HBED? Färbt ebenfalls und ist ein extrem stabiler Komplex, an den die Pflanzen nicht so leicht rankommen.
In diesem Sinne…
Robert
die Tage bin ich über ein interessantes Paper gestolpert, nämlich dem hier: Synthetic iron chelates as substrates of root ferric chelate reductase in green stressed cucumber plants. Darin geht's um die Reaktion von Eisen-chlorotischen Gurken auf verschiedene Eisenchelate, genauer, um die Aktivität der Eisen(III)chelatreduktase an den Wurzeln und um die Eisenkonzentration im Xylem-Saft. Gurken als Strategie-I-Pflanzen bedienen sich des Eisenchelatreduktase-Tricks zur Eisenaufnahme. Sie scheiden das Enzym an den Wurzeln aus, das vom drei- zum zweiwertigen reduzierte Eisen fällt wie von Zauberhand aus dem Komplex, weil die meisten Komplexe mit Eisen(III) viel stabiler sind als mit Eisen(II), und nehmen es auf. Innerhalb der Pflanze wird es allerdings wieder oxidiert und als Eisen(III) weitertransportiert.
An den Gurken hat man Fe(III)-EDTA und Fe(III)-EDDHA getestet. Mit dem Fe(III)-EDTA war zwar die Aktivität der Eisenchelatreduktase an den Wurzeln höher, allerdings die Eisenkonzentration im Xylemsaft geringer als beim Fe(III)-EDDHA. Warum? Fe(III)-EDTA ist weniger stabil als Fe(III)-EDDHA und kann daher von der Reduktase leichter zerlegt werden, allerdings zeigt EDTA auch noch eine gewisse Stabilität mit Fe(II). Das Eisen bleibt daher mit EDTA chelatiert und die Pflanze schaut mit'm Ofenrohr ins Gebirg… Fe(III)-EDDHA ist zwar stabiler und kann daher von der Reduktase nicht so leicht angegriffen werden, aber es zeigt keine Affinität zum Fe(II). Das kann dann die Pflanze gemütlich wegnuckeln.
Zudem: Der Fe(III)-EDTA-Komplex ist nur bis etwa pH 6,3 stabil. Mit zunehmendem pH-Wert steigt die Konzentration der Hydroxidionen (OH⁻) im Wasser. Exponentiell, wir erinnern uns, pro ganzer pH-Stufe um den Faktor 10. Diese Hydroxidionen konkurrieren mit dem EDTA ums Eisen(III) und mit zunehmendem pH-Wert verliert das EDTA das Match. Es bildet sich zunehmend unlösliches Eisen(III)-hydroxid (Fe(OH)₃), das ausfällt. Dieser Prozess beginnt bereits ab pH 6,0. Und dann wundert man sich, warum soviel Eisen im Filterschlamm landet. Ganz einfach, weil EDTA ein untauglicher Chelator ist. Zudem durchläuft es Kläranlagen fast unbeschadet, EDTA findet sich inzwischen in so gut wie allen Oberflächengewässern Deutschlands.
Trotzdem ist das Paper kaum auf Aquarien anzuwenden, weil Fe(III)-EDDHA extrem färbt, selbst noch bei aquarienüblichen 0,1 mg Eisen pro Liter. Was bieten sich dem Aquarien für Alternativen? Fe-DTPA. Besser als EDTA. Fe-IDHA. Gut, aber IDHA wird schnell organisch abgebaut, daher eher als Tagesdünger geeignet. Genauso wie organische Eisenverbindungen wie Eisengluconat und und Eisencitrat. Fe-HBED? Färbt ebenfalls und ist ein extrem stabiler Komplex, an den die Pflanzen nicht so leicht rankommen.
In diesem Sinne…
Robert